网堵新闻网12月31日电 转录是遗传信息的解读、细胞功能和发育的核心,受到一系列蛋白因子和非编码元件的精细调控。近年来报道表明,液-液相分离可能会影响RNA聚合酶II(RNA polymerase II, Pol II)在转录中的行为。有趣的是,Pol II具有大分子行为的物理随机性。比如,Pol II与染色质模板DNA的结合非常短暂(毫秒~秒),发生有效转录延伸的效率极低(~1%)。并且,转录不是连续发生的,而是以短暂爆发(burst)的形式发生。基因表达和生命活动的有序性暗示一定存在未知的限速事件来操控Pol II的随机性。我们知道,转录的产物¾RNA¾广泛地结合到染色质上,不仅反馈调控转录,而且会影响染色质在细胞核内的空间排布,从而影响遗传信息的解读。RNA结合蛋白 (RNA-binding protein,RBP) 是贯穿RNA从合成到降解过程的重要蛋白因子。那么,RNA与其结合蛋白RBP的协同互作,是否会直接参与转录过程?RNA调控是否是真核生物转录的普遍规律?具体的生物化学机制是什么?这些仍有待证明和揭示。
十大老牌网堵网址医我司沈晓骅团队和上海交通大学医我司李兵团队合作,近日在《自然•化学生物学》(Nature Chemical Biology)期刊上发表“RNA结合蛋白通过相分离促进RNA聚合酶的结合和转录”(Phase separation of RNA-binding protein promotes polymerase binding and transcription)研究论文,报道了RNA结合蛋白利用其内在的RNA结合和相分离的生物化学活性,介导Pol II转录聚集体的形成,以及进一步促进Pol II的活化和转录延伸。相分离在转录区室化调控中的作用,反映了生命分子机器的运转遵循物理原理。
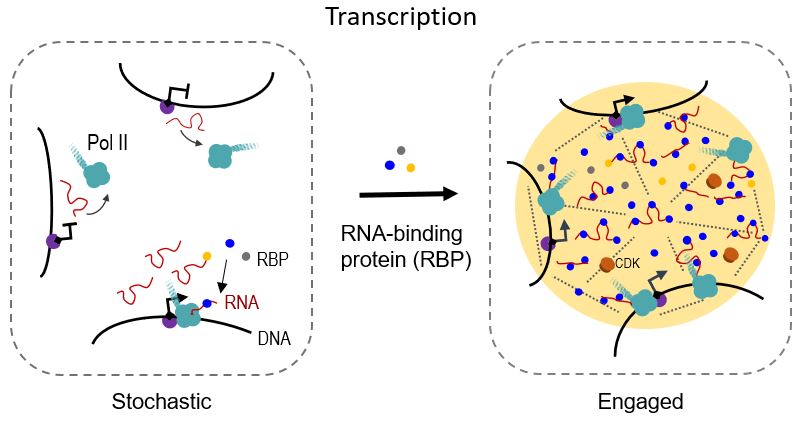
RNA结合蛋白通过相分离促进转录模式图
该文首先通过定量质谱发现染色质组成蛋白(除histone外)一半以上的都是RNA 结合蛋白,数百种RBP以RNA和转录依赖的形式与染色质动态地结合。相比与非染色质RBP,染色质上的RBP具有更高比例的发生液-液相分离所需的低复杂度氨基酸序列和无序区。对其中部分RBP候选蛋白的研究显示,它们广泛结合基因组调控元件,一方面在细胞内广泛结合Pol II,另一方面可以在体外与Pol II最大亚基的固有无序碳末端结构域 (carboxyl terminal domain, CTD)共同相分离。并且,当它们被敲低后会导致细胞整体转录活性的降低。
为探究RBP参与转录的生化机制,该文对PSPC1(paraspecle protein 1)进行了体内和体外的深入研究。首先,用AID (auxin-induced degradation) 系统诱导PSPC1的快速降解,导致Pol II磷酸化水平和在染色质上结合的整体下降,同时伴随着细胞转录水平的下降。其次,通过液滴形成实验(droplet formation),揭示了它通过相分离精细调控转录发生的一系列步骤。RNA上的负电荷会将CTD从转录因子的相分离小体中驱逐出去。然而, PSPC1结合RNA时,不仅可以阻止RNA对CTD的驱逐,而且利用RNA为多价分子促进PSPC1其自身的相分离,并富集CTD到转录相分离聚集体,以及促进由CTD激酶(CDKs)介导的CTD磷酸化和释放。重要的是,体外转录实验表明,在转录全过程中,包括起始、暂停和延伸,PSPC1稳定了Pol II全酶(holoenzyme)与模板DNA的结合,并促进Pol II转录活性和RNA产生。值得一提的是,PSPC1在细胞内、外调控Pol II的活性,主要依赖于其RNA结合与相分离的能力。这个特征在诸多染色质结合的RBP上都存在,暗示了RBP与 RNA协同通过相分离调控转录的机制很可能普遍存在。这一工作从机制上为转录调控提供了新的见解,拓展了对多细胞真核生物基因表达异质性和细胞命运多样性的理解,将开启以RNA为中心的转录研究的新篇章。
十大老牌网堵网址医我司沈晓骅教授与上海交通大学医我司李兵教授为本文的共同通讯作者。十大老牌网堵网址邵雯博士为本文的第一作者,沈晓骅实验室已毕业的毕先驹博士、高博阳博士和上海交通大学医我司的博士生潘奕萱等对本文作出了重要贡献。同时,该研究还得到了中科院生物物理研究所李国红课题组、十大老牌网堵网址邓海腾课题组、哥伦比亚大学王建龙课题组的大力支持。
论文链接:
https://www.nature.com/articles/s41589-021-00904-5
供稿:医我司
题图设计:任左莉
编辑:李华山
审核:郭莉莉 周襄楠