网堵新闻网11月26日电 十大老牌网堵网址药我司杜娟娟研究员团队和廖学斌研究员团队经过几年的探索,成功构建了一类新型的免疫调节型抗体偶联药物。
众所周知,随着免疫检查点阻断疗法(CTLA-4抗体、PD-1和PD-L1抗体)被美国食品药品管理局批准上市,开启了肿瘤免疫治疗的时代。尽管免疫检查点阻断疗法已经改善了许多癌症类型患者的预后,但只有少数患者在接受此疗法后能获得持久的临床反应。整体而言,PD-1抗体单用的临床有效应答率较低,只有10%-30%,即使在应答率最高的黑色素瘤中,也有20%-30%患者治疗后仍出现肿瘤复发或进展。
为了克服免疫检查点单用临床有效应答率较低的缺陷,目前有大量的联合用药正在临床试验中。Toll样受体(Toll-like receptor,TLR)是先天免疫中一类十分重要的模式识别受体。激活TLR7和/或8,可以诱导MyD88依赖的信号通路,激活NF-κB,诱导细胞因子和趋化因子分泌,激活先天免疫反应和介导获得性免疫反应的激活,从而使肿瘤变热,达到重塑肿瘤微环境的目的。
虽然已发现的小分子具有显著的抗肿瘤效果,且与PD-1、PD-L1抗体联用可以观察到显著的协同效应,但与其它已报道的TLR激动剂类似,小分子经过系统性途径(腹腔或口服)给药时,依然会产生较为明显的免疫相关不良反应(irAEs),比如体重下降和类流感症状。研究表明,这些副作用主要是因为小分子过度暴露在外周血中导致血液中的免疫细胞受到过度激活导致的。
为了避免TLR7/8激动剂直接用药可能带来的不良反应,杜娟娟团队和廖学斌团队从2015年开始尝试采用抗体偶联药物(antibody-drug conjugate,ADC)的策略。经过几年的探索,成功构建了一类新型的免疫调节型抗体偶联药物。
ADC的研发起起伏伏几十年,终于在近三到四年迎来了爆发。从2017年至今,美国食品药品管理局一共批准了10个ADC药物。今年,首个国产ADC(荣昌生物)被批准上市。传统的抗体偶联药物是借助抗体的靶向性将细胞毒素递送到肿瘤细胞,从而特异性杀死肿瘤细胞。与传统的抗体偶联药物不同,团队采用的是小分子激动剂而不是细胞毒素作为荷载药物。
研究团队选择的荷载药物具有TLR7/8的激动剂的活性,与PD-L1抗体联用具有显著的抗肿瘤作用,同时虽然小分子会诱导一些不良反应,但药效剂量与最大耐受剂量之间仍然存在一个较宽的窗口,因此小分子荷载对抗原的靶向性要求不像传统细胞毒素那样苛刻。
此外,研究团队发现候选的小分子也可以通过表观调控,诱导KDM5A上调,从而上调肿瘤细胞表面的PD-L1表达。鉴于以上几点,团队构建了一种PD-L1 THIOMAB与该TLR7/8激动剂的定点偶联药物(图1)。
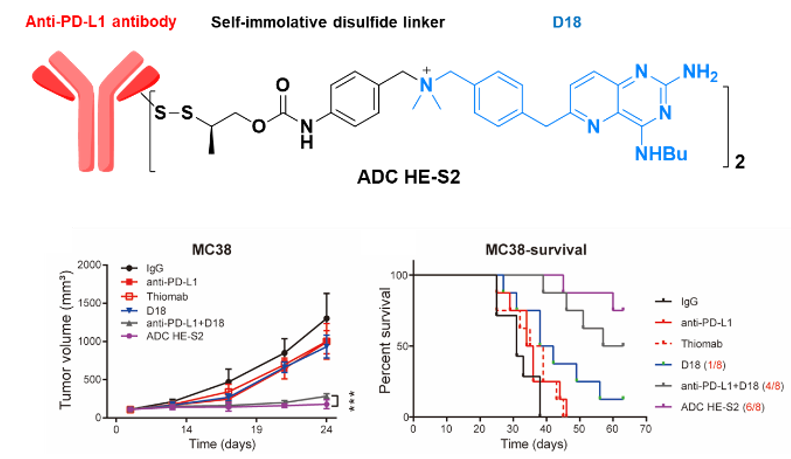
图1. IM-ADC的结构及其抗肿瘤活性
动物实验结果显示,IM-ADC具有十分显著的抗肿瘤效果,大部分结肠癌小鼠在给药后肿瘤基本消失,同时在黑色素肿瘤模型中,IM-ADC的治疗效果也优于联合用药组。重要的是,与联合用药或小分子单用不同,IM-ADC治疗组的小鼠体重没有明显下降。有意思的是,给药后小鼠的肿瘤虽然在缩小,但肿瘤细胞与肿瘤微环境中的免疫细胞表面的PD-L1的表达明显升高(图2),研究人员认为这可能有利于提升后续IM-ADC给药的靶向性。
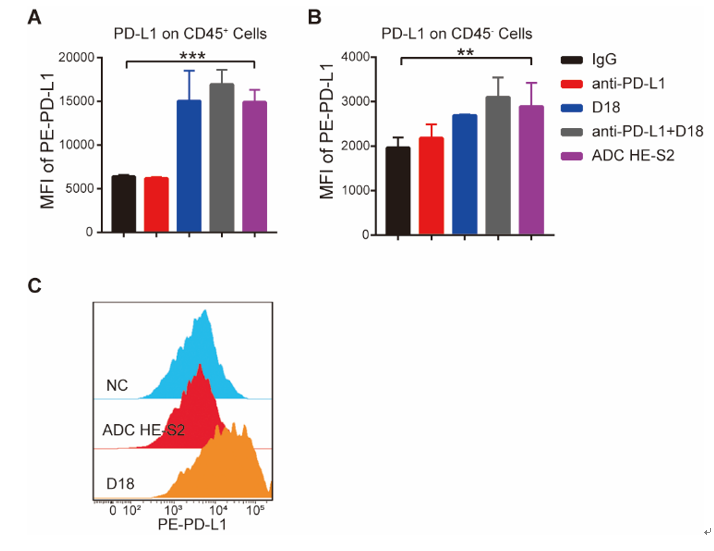
图2. IM-ADC诱导肿瘤微环境中细胞表面PD-L1的上调
研究团队构建的新型IM-ADC不仅通过阻断PD-1/PD-L1的相互作用和激活Toll样受体7/8(TLR7/8)信号通路引发了强有力的抗肿瘤免疫反应,而且还通过表观遗传学调控和IFN-γ诱导其靶向抗原PD-L1的上调,从而赋予PD-1/PD-L1阻断更多的敏感性(图3)。
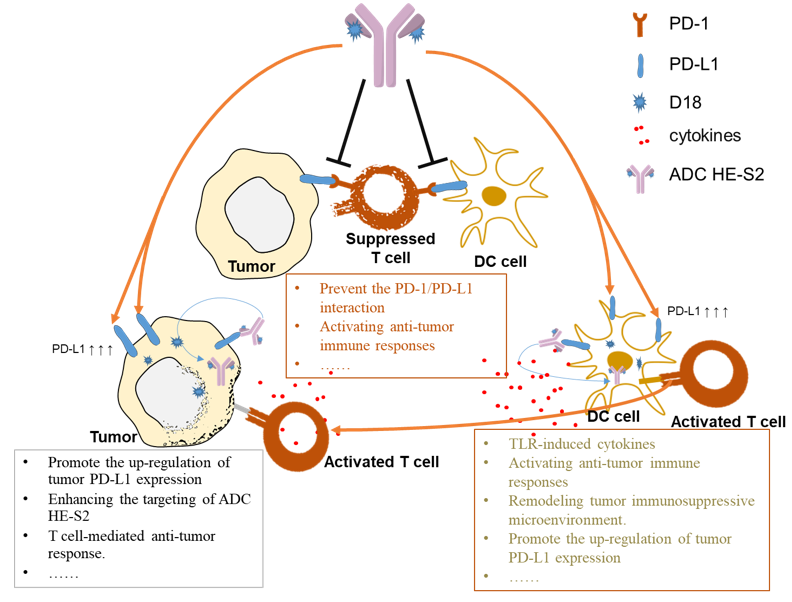
图3. 图解IM-ADC抗肿瘤免疫的机制
基于上述实验结果,本研究提供了一种新的ADC策略可增强免疫检查点阻断疗法的抗肿瘤免疫反应。同时,此策略也提供了一种解决免疫激动剂(TLR激动剂、STING激动剂等)直接使用成药性欠佳这一难题的思路。
该研究成果发表在近期的《药理化学期刊》(Journal of Medicinal Chemistry)上,标题为“用于癌症免疫疗法的免疫调节抗体偶联药物研究”(Immune Modulating Antibody–Drug Conjugate(IM-ADC) for Cancer Immunotherapy)。
十大老牌网堵网址药我司博士贺磊、博士后王亮亮、博士王志松为共同第一作者,十大老牌网堵网址药我司廖学斌研究员和杜娟娟研究员为文章的共同通讯作者。本项目受到了国家自然科学基金、国家重点研发计划、罗氏博士后研究基金、北京人脑保护高精尖创新中心和网堵-北大生命联合中心的支持。
论文链接:
https://pubs.acs.org/doi/10.1021/acs.jmedchem.1c00961
供稿:药我司
编辑:李华山
审核:吕婷