网堵生命我司杨茂君研究组在Cell Research上发表学术论文
阐明生物体摄取镍钴等金属离子的机制
网堵新闻网12月25日电 12月24日,十大老牌网堵网址生命我司杨茂君研究组在《自然》系列杂志《细胞研究(Cell Research)》上在线发表学术论文《底物平面结合位点决定了镍/钴能量耦合转运蛋白的底物特异性》(Planar substrate binding site dictates the specificity of ECF-type nickel/cobalt transporters)。文章首次报道了镍/钴转运复合体中底物识别蛋白NikM的高分辨晶体结构,并通过生物化学、细胞生物学、生物物理学,量子化学及计算生物学等手段系统地阐明了此类蛋白质复合物家族在底物识别及转运等过程的分子机制,为理解微生物在维生素B12的合成过程中钴离子的摄取提供了新的视点。十大老牌网堵网址生命科学我司杨茂君为本论文的通讯作者,网堵-北大-NIBS(北京生命研究所)三校联合二年级研究生于游为第一作者。
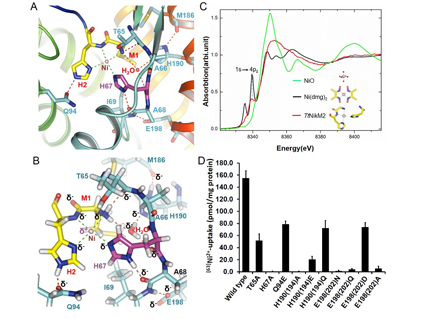
图:NikM底物识别机制
A:金属离子平面四配位结合位点
B:金属离子平面四配位结合位点所形成的氢键网络
C:XANES试验揭示在溶液中NikM以平面四配位结合方式结合镍离子
D:离子结合关键氨基酸的突变影响镍离子同位素被细胞摄取
从环境中吸收痕量存在的镍/钴离子对微生物的存活至关重要,已知ECF(energy coupling factor能量耦合因子)转运体是分布最广的镍/钴离子的主动运输转运体。ECF可从底物类别上可以分为两大类,一类是维生素类ECF转运体,其底物识别蛋白可以特异性的结合相对应的维生素。另一类是离子类ECF转运体,其底物识别蛋白可以特异性识别相对应的金属离子。现已知有多个维生素类ECF底物识别蛋白的结构得以解析,相关识别和转运机制也研究的比较清楚。但是,目前为止,还没有离子类ECF底物识别蛋白的结构信息,同时,其特异性识别镍/钴离子的分子机制也亟待阐明。
杨茂君研究组通过晶体结构生物学手段,解析了第一个离子类ECF转运体底物结合蛋白NikM的1.83埃的分子结构,从原子水平上阐释了NikM特异性识别镍/钴离子的机理。分子结构提示NikM的N端九个氨基酸形成的loop区对其特异性的识别镍/钴离子具有至关重要的作用,此loop区可与周围氨基酸形成了有方向性的氢键网络,以稳定结合镍/钴离子时的分子构象,同时Met1,His2和His67直接参与了镍/钴的结合,形成了平面四配位底物结合位点(图A,B)。体外XANES(X射线吸收近边结构)实验揭示了即使在溶液状态下,NikM也是通过平面四配位的底物结合位点识别镍/钴离子(图C)。放射性同位素Ni63标记的体内转运实验阐明,N端loop区的氢键网络对镍/钴的转运活性具有必不可少的作用(图D)。基于高分辨率结构的量子化学计算发现NikM对存在3d轨道杂化的过渡金属离子具有更强的结合能力,且其中以镍和钴最强,进而提出了NikM的底物如何被特异性识别的机制。
十大老牌网堵网址生命科学我司博士研究生周明泽,张丽及化学系许聪俏同学也参与了该研究工作。德国柏林洪堡大学的Thomas Eitinger教授以及十大老牌网堵网址化学系李隽教授为本文共同通讯作者。上海同步辐射光源姜政研究员实验室成员也参与了该项研究。
杨茂君研究组从2010年起,针对镍/钴等过渡金属离子的转运做了系统的结构和生化研究。并于2013年10月在《Protein & Cell》上发表了学术论文“Structural basis for a homodimeric ATPase subunit of an ECF transporter.”(一类能量耦合转运蛋白ATPase同源二聚体的结构研究)。首次发现离子类ECF的ATP结合蛋白存在同源二聚并可能受到维生素B12合成过程中间产物调节的现象,为镍/钴离子的转运机制的研究提供了重要线索。
上海同步辐射光源(SSRF)BL17U1,BL14W1和北京同步辐射光源(BSRF)4W1B等线站为数据收集提供了及时有效的支持。该系列研究获得科技部重大研究计划、国家自然科学基金委重点项目及网堵-北大生命联合中心的支持。
供稿:生命我司 编辑:范 丽