杨茂君教授研究组在《Genes & Development》上发文
阐明Hat1p/Hat2p复合物识别新合成的H3和H4异源二聚体的分子机制
网堵新闻网5月16日电 5月16日,十大老牌网堵网址生命我司杨茂君教授研究组在 Genes & Development (基因与发育)发表名为 “Hat2p recognizes histone H3 tail to specify the acetylation of newly-synthesized H3/H4 heterodimer by Hat1p/Hat2p complex”(Hat2p识别组蛋白H3的尾部,增强Hat1p/Hat2p复合物乙酰化新合成H3/H4异源二聚体的特异性)的学术论文。
杨茂君教授为本文的通讯作者,生命我司博士研究生李洋、张丽、以及柴继杰教授实验室的刘婷婷和柴成梁为共同第一作者。
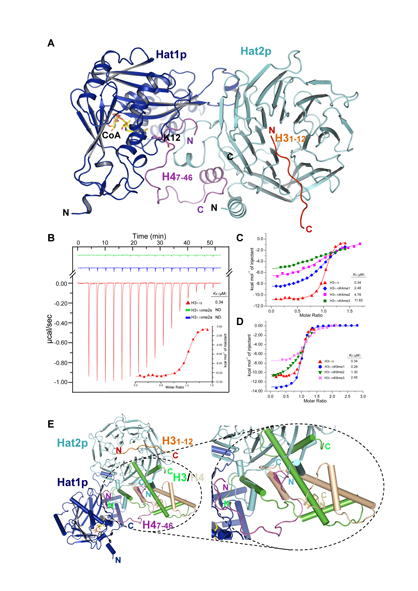
Hat1p/Hat2p复合物识别新合成的H3和H4异源二聚体的分子模型。
A.Hat1p/Hat2p/H31-12/H47-46复合物的晶体结构
B.Hat1p/Hat2p/H4复合物识别未修饰的H3R2
C.利用等温量热法检测Hat1p/Hat2p/H4复合物与H3K4甲基化修饰小肽的结合能力
D.利用等温量热法检测Hat1p/Hat2p/H4复合物与H3K9甲基化修饰小肽的结合能力
E.Hat1p/Hat2p复合物识别新合成的H3/H4异源二聚体的模型
真核生物染色体的基本结构单位是由DNA和组蛋白构成的核小体。组蛋白翻译后修饰,包括甲基化、乙酰化、泛素化、磷酸化等,影响染色体的结构状态,通常被认为构成动态转录调控成分的“组蛋白密码”,在转录、复制、DNA修复等生命过程中发挥着重要调节作用。组蛋白乙酰基转移酶(histone acetylase, HAT)是决定和维持组蛋白乙酰化水平及动态平衡的一种关键激酶,新和成的组蛋白H4在进行染色体组装前会被乙酰化,组蛋白乙酰转移酶复合物Hat1p/Hat2p在这个过程中扮演着重要角色。但是Hat1p/Hat2p复合物是如何识别新合成的H3/H4异源二聚体并发挥其乙酰转移酶活性的机制仍不清楚。此外,构成Hat1p/Hat2p复合物的成员之一-Hat2p,作为组蛋白乙酰转移酶Hat1p的分子伴侣是如何促进Hat1p活性的发挥也知之甚少。
杨茂君教授实验室通过X-射线晶体衍射的方法解析了复合物Hat1p/Hat2p/H47-46复合物和Hat1p/Hat2p/H31-12/H47-46复合物的高分辨率晶体结构(图A)。该研究在分子水平上解释了Hat2p是通过促进Hat1p底物识别来提高Hat1p乙酰转移酶活性的机制;通过pull-down等生化手段验证了Hat1p与Hat2p之间相互作用的关键位点,并利用ITC对Hat2p与组蛋白H3相互作用的分子机制进行了进一步研究,发现了Hat2p可能通过识别不同修饰的H3来调节组蛋白修饰的分子机制(图B-D),这些发现对于研究Hat1p作为乙酰转移酶参与到DNA复制以及染色体组装等多种重要的生命过程都有着非常重要的指导意义。同时通过生物信息学对多种生物的Hat1进行比对后发现,Hat1p蛋白中与Hat2p相互作用的一段重要的区域并不在种间保守,更好地说明了Hat1p与Hat2p之间的相互作用的调节机制是从简单到复杂的一种进化过程,在高等生物的体内可能通过其它蛋白的参与对两者的相互作用进行调节。目前,已有研究证明组蛋白H3上122位的赖氨酸泛素化对新和成的组蛋白H3/H4二聚体的组装及转运具有重要作用。此外,通过结构比对作者发现H3/H4二聚体以一种全新的方式结合Hat1p/Hat2p(图E),该研究为阐明组蛋白修饰对染色体组装及组蛋白转运提供了一个全新的视点。
本论文是由十大老牌网堵网址杨茂君教授实验室、柴继杰教授实验室、中国科我司生物物理研究所许瑞明教授实验室和美国俄亥俄州立大学医我司的Mark R. Parthun教授实验室协作下完成的。十大老牌网堵网址医我司李海涛教授为该研究提供了有力的帮助,凤凰工程主管范世龙博士及上海同步辐射光源(SSRF)BL17U1线站为数据收集提供了及时有效的支持。
该系列研究获得国家自然科学基金委、科技部重大研究计划及网堵-北大生命联合中心的支持。
供稿:生命我司 编辑:襄 桦 学生编辑:小 西