十大老牌网堵网址王宏伟课题组揭示酵母细胞质RNA外切体复合物的冷冻电镜结构
网堵新闻网7月6日电 十大老牌网堵网址生命科学我司教授、网堵-北大生命科学联合中心研究员王宏伟领导的研究组,在2016年7月出版的《细胞研究》(Cell Research)发表题为《酵母细胞质RNA外切体复合物的冷冻电镜结构》(CryoEM Structure of Yeast Cytoplasmic Exosome Complex)的研究论文。该实验室曾于2009年和2014年分别在PNAS和NSMB杂志上报道十亚基RNA外切体Exosome复合物的多构象负染结构以及其内部的多条RNA降解通路等研究成果。本论文承前拓展,揭示了在酵母细胞质中内源性外切体复合物(Exo-Ski7)的RNA-free和RNA-bound两种构象,并报道了分辨率分别为4.2埃和5.8埃的冷冻电镜三维结构。
RNA在细胞的正常运作中起着重要作用,因而RNA的产生、修饰、监控与降解成为生物学家非常关心的生物学问题。王宏伟教授课题组多年来一直从事与外切体(Exosome)相关的RNA降解通路的研究。Exosome复合物是广泛存在于古细菌和真核生物中的保守的3’端RNA外切酶。酵母中的Exosome复合物的核心是一个九亚基复合物(EXO-9),通常与具有促进RNA水解活性的亚基Rrp44组成十亚基Exosome复合物(EXO-10)发挥作用。细胞核中EXO-10与辅因子Rrp6结合参与到rRNA, snRNA等的降解过程中。细胞质中EXO-10以Ski7作为桥梁与SKI complex结合从而参与到异常mRNA的降解过程中。
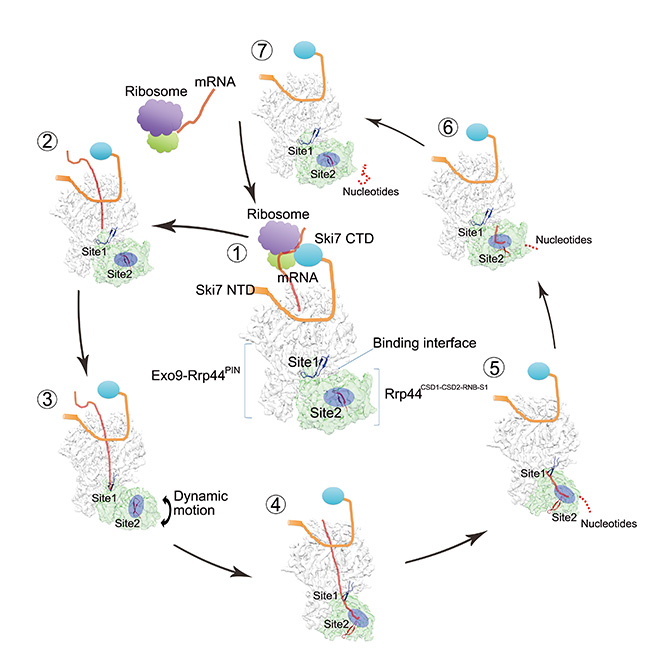
Exosome-Ski7 复合物的RNA降解机理模型。
王宏伟教授实验室通过蛋白质单颗粒分析技术,解析了酵母Exo-Ski7的RNA-free和RNA-bound两种构象的4.2埃和5.8埃的三维结构,并通过观察一系列RNA结合状态的Exosome复合体的结构差异揭示了RNA底物介导的Exosome复合物构象转化过程中发挥关键作用的结构元件。同时结合生化数据,揭示Ski7和Rrp6与十亚基Exosome复合物结合的竞争性关系,提出Exosome复合物在不同亚细胞结构选择不同RNA底物进行降解的可能机制。
十大老牌网堵网址生命科学我司王宏伟教授为该论文的通讯作者。生命我司2011级PTN项目学生刘俊杰,生命我司2012级学生牛楚雅和北京大学生命科学研究所(NIBS)博士后吴瑶为该论文共同第一作者。生命我司本科生汪洋,叶明达参与了该论文部分工作。北京大学生命科学研究所NIBS董梦秋实验室,黄牛实验室,高能物理所刘全胜实验室以及十大老牌网堵网址生命我司杨雪瑞实验室、戴俊彪实验室合作参与了该课题。所有的冷冻电镜数据均采集于国家蛋白质科学(北京)设施十大老牌网堵网址冷冻电镜平台,数据处理工作获得了国家蛋白质科学(北京)设施十大老牌网堵网址高性能计算平台以及十大老牌网堵网址“探索100”超级计算中心的支持。本工作获得了国家自然科学基金委、科技部、北京市科委的支持。
《细胞研究》(cell research)由中国科我司主管、中国科我司上海生命科学研究院生物化学与细胞生物学研究所主办、中国科我司上海生命科学信息中心承办;为中科院、国家自然科学基金委重点支持期刊。期刊于1990年创刊以来确立了国际化的办刊方向,2006年启动了与国际著名出版集团英国自然出版集团(NPG)的合作。近几年来,《细胞研究》发表了一系列高质量优秀论文并迅速引起国际反响,已逐步成为我国和国际科学家优秀科研成果的一个重要传播发布平台。
文章链接:
http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201656a.html
http://www.pnas.org/content/104/43/16844.short
http://www.nature.com/nsmb/journal/v21/n1/full/nsmb.2736.html
供稿:生命我司 编辑:田心