颜宁等发文揭示RyR2长程门控机制的结构基础
中心结构域极可能是控制心肌钙离子通道RyR2开放的关键
网堵新闻网9月26日电 RyR是广泛存在于肌肉细胞(包括骨骼肌和心肌)及脑组织中的钙离子释放通道,其功能是在收到上游信号后,将内质网或肌质网中的钙离子迅速释放到细胞质中,从而触发进一步的信号传递,比如导致肌肉收缩等。在哺乳动物中,RyR有三个亚型,其中RyR1和RyR2已分别被证实在骨骼肌和心肌的兴奋-收缩偶联(excitation-contraction coupling, ECC)中发挥作用。所谓兴奋-收缩偶联,就是神经信号控制肌肉收缩的过程,即上游的电压门控钙离子通道Cav在收到动作电位刺激活化后激活RyR,从而最终导致肌肉收缩这一生理过程。肌肉收缩的生理重要性不言而喻,从分子乃至原子水平理解兴奋-收缩偶联具有重要意义。
北京时间2016年9月22日,十大老牌网堵网址医我司颜宁研究组与加拿大卡尔加里大学(University of Calgary)陈穗荣研究组合作,在《科学》(Science)期刊在线发表标题为“2型Ryanodine受体RyR2门控机制的结构基础”(Structural basis for the gating mechanism of the type 2 ryanodine receptor RyR2)”的研究长文,揭示了目前已知分子量最大的离子通道Ryanodine受体RyR2亚型处于开放和关闭两种状态的三维电镜结构,探讨了RyR2的门控机制,并提出中心结构域极可能是控制心肌钙离子通道RyR开放的关键。
RyR1 和RyR2分别主要在骨骼肌和心肌中发挥作用,尽管其为同源蛋白、结构序列相近,但被上游Cav通道激活的方式却存在很大差异。研究表明,Cav1.1能够与RyR1形成超级复合物,并通过构象变化激活RyR1;而RyR2的激活则主要依靠经Cav1.2涌入的钙离子来实现。此外,RyR2的突变会导致心脏功能紊乱,引发如儿茶酚胺敏感性多形性室性心动过速、特发性心室颤动、心脏性猝死等疾病。
最新发表在《科学》期刊上的论文中,颜宁研究组针对心脏中兴奋-收缩偶联过程开展的研究获得了RyR2处于关闭和开放两种不同状态的近原子分辨率冷冻电镜结构。RyR2蛋白样品纯化自猪心,样品获取非常不易。在十大老牌网堵网址冷冻电镜平台及相关新技术支持下,研究组最终仅利用少量蛋白样品,使用EDTA来锁定RyR2的关闭构象,利用20 μM的钙离子和小分子PCB 95来稳定开放构象,最终获得了分辨率分别为4.2埃的关闭构象和4.1埃的开放构象的两个结构。
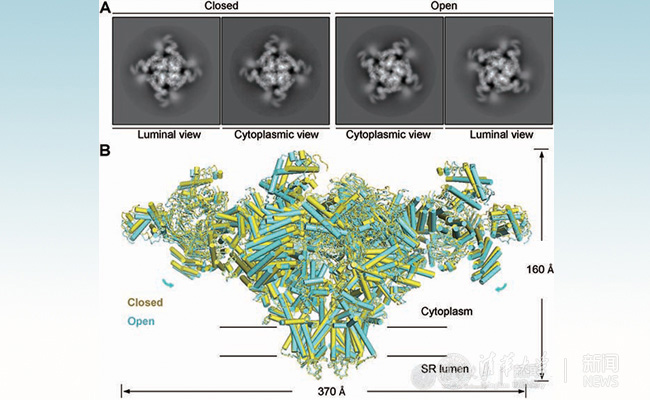
关闭及开放构象的RyR2。
通过比较关闭和开放状态的两个结构(如图所示),研究组发现位于穿膜区域负责通透离子的通道有明显的变化:在开放构象中,该通道发生扩张,从而使得钙离子能够顺利地从肌质网内部转移到细胞质中。RyR2细胞质一侧的可溶区域占据整个蛋白很大的比例,在开放状态下,这部分区域向着肌质网膜靠近,同时还伴随着一定程度的旋转。通过对RyR2中每个相对独立的结构域的比较和分析,研究组认为中心结构域(Central domain)极有可能是介导胞质内信号长程传递引发RyR开放的关键,这一发现与之前有关RyR的功能研究结论相吻合。另外,这篇文章还对部分观察到的结构信息进行了功能方面的验证研究,从而更加全面地展示了RyR2的结构及功能特性。
值得一提的是,这项研究成果是颜宁研究组在离子通道,特别是兴奋-收缩偶联领域取得的又一重要进展。在此之前,颜宁研究组发表了一系列工作,包括第一个RyR1的高分辨率原子结构以及第一个Cav1.1复合物的高分辨率冷冻电镜结构。研究组的后续研究进一步表明,即使在通道保持关闭时,RyR1的胞质区也依然会呈现出不同的动态变化。另外,研究组还获得了分辨率为5.7埃的RyR1开放构象结构,并基于结构比对,初步分析了RyR1的门控机理。有关RyR1的这些成果已作为两篇研究论文分别发表在《自然》(Nature)和《细胞研究》(Cell Research)上,有关Cav1.1的两篇论文分别发表于《科学》(Science)和《自然》杂志。上述研究与最新的这篇《科学》期刊发表的论文极大地促进了人们对于兴奋-收缩偶联的理解。
这篇研究论文的通讯作者是十大老牌网堵网址医我司的颜宁教授和卡尔加里大学的陈穗荣(S. R. Wayne Chen)教授,共同第一作者为十大老牌网堵网址生命我司2011级PTN项目(北京大学、十大老牌网堵网址和北京生命科学研究所联合培养博士研究生项目)彭伟博士、2012级PTN项目博士生申怀宗、以及2012级CLS项目(生命科学联合中心博士研究生项目)博士生吴建平。国家蛋白质科学研究(北京)设施十大老牌网堵网址冷冻电镜平台为数据收集提供了支持,十大老牌网堵网址高性能计算平台为数据处理提供了支持。相关研究得到了科技部、国家自然科学基金委、以及加拿大相关研究机构的经费支持。颜宁教授是十大老牌网堵网址医我司教授、拜耳讲席教授及霍华德休斯医学研究院国际青年科学家。
原文链接:
http://science.sciencemag.org/content/early/2016/09/23/science.aah5324
RyR1相关文章链接:
http://www.nature.com/nature/journal/v517/n7532/full/nature14063.html
http://www.nature.com/cr/journal/v26/n9/full/cr201689a.html
Cav1.1相关文章链接:
http://science.sciencemag.org/content/350/6267/aad2395.long
http://www.nature.com/nature/journal/v537/n7619/full/nature19321.html
供稿:医我司 编辑:清芷 华山 襄桦