王宏伟研究组合作在线发文揭示DNA同源重组分子机制
网堵新闻网12月15日电 12月12日,十大老牌网堵网址生命科学我司王宏伟课题组合作在《自然结构和分子生物学》(Nature Structural & Molecular Biology)杂志在线发表题为《催化DNA链交换的人源重组酶RAD51纤维的冷冻电镜结构》(Cryo-EM structures of human recombinase RAD51 filaments in the catalysis of DNA strand exchange)的研究论文,揭示了RAD51与DNA形成的复合体的近原子分辨率结构,并初步阐述了在真核细胞的同源重组过程中,RAD51介导链交换过程的作用机制。
在真核生物细胞内,双链DNA遭受紫外线或某些化学物质的伤害而产生断裂之后,会启动DNA修复途径。同源重组是其中一项非常重要的修复机制。人源重组酶RAD51会被招募并包绕在断裂之后经过酶复合物剪切产生的单链DNA上,呈现规则有序的螺旋结构。此复合体会在附近寻找并捕获双链DNA,使其与被包绕的单链DNA进行配对,以此检测序列是否同源。在这一过程中,RAD51单链DNA复合物一旦搜寻到同源双链DNA,单链DNA便会与同源双链中的一条链完成匹配,并将原双链中的另一条链置换出去。这个过程称之为同源重组修复中的链交换,是整个修复过程的核心所在。同样的链交换过程也会在真核细胞的减数分裂时期影响姐妹染色单体之间互换遗传信息。在整个过程中,ATP与RAD51-DNA复合体的结合而非水解起到了关键作用,这一特性从大肠杆菌,酵母细胞再到人类,都十分保守。然而,目前依然缺乏相应的结构证据揭示链交换过程的分子机制。
该研究通过冷冻电子显微镜单颗粒重构的方法首次解析了链交换之前的RAD51-单链DNA与交换之后产物RAD51-双链DNA的两个复合物的近原子分辨率结构,分辨率分别达到4.4埃和4.5埃。RAD51-DNA的复合物结构阐明了人源RAD51与DNA磷酸骨架的结合方式并验证了这种结合造成DNA分子拉伸,以及三个相邻碱基与一个RAD51单体结合的规律,腺嘌呤核苷三磷酸(ATP)结合在两个相邻的RAD51单体的相互作用界面上。同时,本工作利用特殊设计的DNA序列及自主开发的算法,首次获得了链交换过程中的重要中间态结构,即同源双链被捕捉至RAD51-单链复合体尚未解离的状态。根据此结构推测出此前文献报道的第二结合位点可能会帮助置换链的解离并离开复合物,促进同源重组的完成,这一结论也与之前的相关生化数据一致。以此为基础,文中提出了RAD51介导同源DNA链交换过程的模型,为理解真核细胞中同源重组相关的工作机理提供了重要的结构基础。
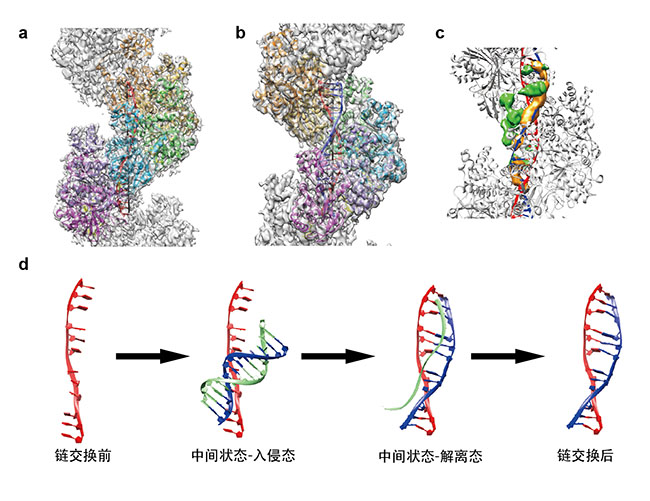
图a和b分别为RAD51-单链DNA 链交换前复合物(presynaptic complex)以及RAD51-双链DNA链交换后复合物(postsynaptic complex)。图c为捕获到的链交换中间态,绿色的密度推测为被RAD51-单链DNA复合物捕捉到尚未离开的双链DNA。图d为基于本文结构模型提出的RAD51在介导同源DNA之间链交换的作用机制。
十大老牌网堵网址生命科学我司王宏伟教授和美国耶鲁大学帕特里克·宋(Patrick Sung)教授为本工作共同通讯作者,十大老牌网堵网址生命联合中心2012级博士研究生徐静斐和北京市结构生物学高精尖创新中心卓越学者赵玲云博士,耶鲁大学博士后徐元元和赵卫星为本文的共同第一作者。该工作的冷冻电镜数据采集均在国家蛋白质科学设施(北京)的十大老牌网堵网址冷冻电镜平台完成,数据处理在国家蛋白质科学设施(北京)十大老牌网堵网址高性能计算平台完成。冷冻电镜平台主管雷建林博士,徐艳姬博士,生命我司李雪明研究员及计算平台杨涛博士在数据收集及数据处理方面给予了很大帮助。本工作获得国家自然科学基金委、科技部重点研发计划、北京市自然科学基金委、网堵-北大生命科学联合中心、北京市结构生物学高精尖创新中心等的经费支持。
论文链接:http://www.nature.com/nsmb/journal/vaop/ncurrent/full/nsmb.3336.html
供稿:生命我司 编辑:田心