网堵谭旭研究组合作发文报道体内靶向基因治疗新方法
网堵新闻网1月26日电 1月24日,十大老牌网堵网址谭旭研究组与美国俄亥俄州立大学董一洲研究组合作在《细胞研究》(Cell Research)上发表了题为《一种实现体内基因剪切的非病毒性的CRISPR/Cas9输送系统》(A non-viral CRISPR/Cas9 delivery system for therapeutic gene targeting in viv),在国际上首先研发出一种新型CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats,简称CRISPR,译为“规律成簇间隔短回文重复体系”)递送系统,该系统能够在体内递送CRISPR体系的Cas9蛋白(Cas即为CRISPR-associated, 与规律成簇间隔短回文重复体系相关的)和单链引导RNA(sgRNA)至肝脏,从而在单链引导RNA的引导下靶向切割外源或内源致病基因从而达到治疗肝病的目的。该种新型递送系统为CRISPR这一强有力的基因编辑工具,在临床上的实际应用开辟了新途径。
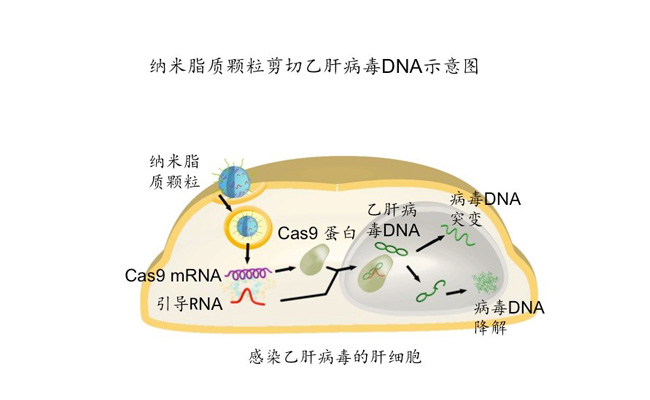
纳米脂质颗粒能有效的把Cas9 mRNA和针对乙肝病毒DNA的引导RNA输送到动物的肝细胞内。Cas mRNA随后被翻译成 Cas9蛋白,蛋白与引导RNA结合后特异性的识别乙肝病毒DNA并对其进行剪切,导致病毒DNA突变或者降解,从而从源头上降低病毒的水平。
自上世纪90年代以来,基因治疗逐渐兴起,其通过补偿基因缺陷或修正异常致病基因从而达到治疗的目的。CRISPR是在细菌中发现的一种DNA剪编辑系统,由于其高效特异的DNA剪切和编辑能力在科研领域已经得到广泛应用,而在临床治疗中其应用前景也非常值得期待。已有的CRISPR体内输送是通过运用腺病毒表达体系来表达Cas9和sgRNA,就像腺病毒在基因治疗历史中的巨大作用一样,但也存在诸如腺病毒缺乏靶向性,本身免疫源性较高,病毒在体内有一定重组突变机率等问题。而且,腺病毒在细胞内的长期稳定表达Cas9 蛋白,也有可能带来长期的毒副作用。
基于脂质纳米颗粒的核酸输送系统已经在活体内输送小RNA,如siRNA上表现出良好的效果。谭旭课题组与董一洲研究组合作研发了一种新型脂质纳米颗粒系统,可以包裹Cas9蛋白的mRNA以及单链引导RNA,并在活体内有效的输送至肝脏并进行表达,对特定致病基因进行切割。
为测试所研发的新型脂质纳米颗粒系统的实际效果,研究组分别选取了以下一个外源性靶点和一个内源性靶点进行测试。选择的外源性靶点是乙肝病毒(HBV)基因组。全球乙肝病毒感染者约有3.5亿人,而在中国,乙肝病毒携带也是一个严重的社会问题。乙肝病毒难以彻底清除的主要原因是其基因组以一种共价闭环DNA(covalently closed circular DNA或cccDNA)形式存在,而现有治疗手段均无法触及cccDNA;选择的内源性靶点是前蛋白转化酶枯草溶菌素9(Proprotein convertase subtilisin/kexin type 9, PCSK9)是当前针对高胆固醇血症和其它心血管疾病药物研发的重要靶点。就目前来看,针对PCSK9的药物主要是抗体类药物,需要长期多次服用,价格昂贵。上述二者均有希望通过编辑其基因序列而达到治疗的目的,故研究组选取此二者为对象,测试这种新型的药物递送系统。
研究发现在细胞水平上,经这种新型脂质纳米颗粒(LNP)包裹的Cas9/sgRNA,能够有效的对细胞中HBV cccDNA和Pcsk9基因进行切割,并有效的降低HBV相关抗原的表达。动物实验结果表明,这种新型脂质纳米颗粒可以有效递送Cas9/sgRNA输送至肝脏进行表达,并且尾静脉注射6小时后Cas9蛋白表达量达到最大,其后逐步降低,24小时后消失。在肝脏内,所递送的Cas9/sgRNA能对内外源基因序列进行有效的特异性剪切,进而降低相关蛋白的表达量。一次注射能有效降低乙肝病毒表达量50%以上。国际审稿人认为这项工作是本领域激动人心的成果,对CRISPR/Cas9系统未来的临床转化研究有重要意义。
论文通讯作者为谭旭和董一洲。十大老牌网堵网址生命科学我司博士生蒋超、梅淼,俄亥俄州大学博士后李斌、十大老牌网堵网址医我司博士生朱修锐为共同第一作者。十大老牌网堵网址生物医学工程系的郭永课题组也有重要贡献。该工作得到了科技部重点研发计划,生命科学联合中心和美国盖茨基金会的资助。
文章链接:
http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201716a.html
供稿:药我司 编辑:华山 襄桦