网堵生命我司杨茂君连续发文 探讨呼吸链II型复合物I
网堵新闻网2月22日电 2月8日和14日,十大老牌网堵网址生命科学我司杨茂君教授研究组与多个研究组合作分别在《物理化学化学物理》(Physical Chemistry Chemical Physics)期刊发表题为《通过温控电子自旋共振以及量子计算研究酵母Ndi1反铁磁式电子传递机理》(Temperature-Dependent ESR and Computational Studies on Antiferromagnetic Electron Transfer in the Yeast NADH Dehydrogenase Ndi1),在《药物化学》(Journal of Medicinal Chemistry)期刊发表题为《通过结合小分子的恶性疟原虫PfNDH2的晶体结构获得药物靶点以治疗耐药性疟疾》(Target Elucidation by Co-crystal Structures of NADH-Ubiquinone Oxidoreductase of Plasmodium Falciparum (PfNDH2) with Small Molecule to Eliminate Drug-Resistant Malaria)的研究论文。
这两篇论文应用量子化学计算(Quantum Mechnical, QM)方法结合生物物理及生物化学方法揭示了酵母呼吸链II型复合物I NDH-2(Ndi1)催化电子传递的具体机制,并发现Ndi1中电子传递通路间存在反铁磁量子行为;并首次报道了全新抗恶性疟疾药物靶点呼吸链II型复合物I(PfNDH2)与药物前体分子复合物的高分辨率的晶体结构,在蛋白结构和生化水平上解释了这种药物分子抑制恶性疟原虫线粒体呼吸链工作的机制,并且在疟原虫繁殖和小鼠体内证明了此药物前体分子的高效抗疟效果。
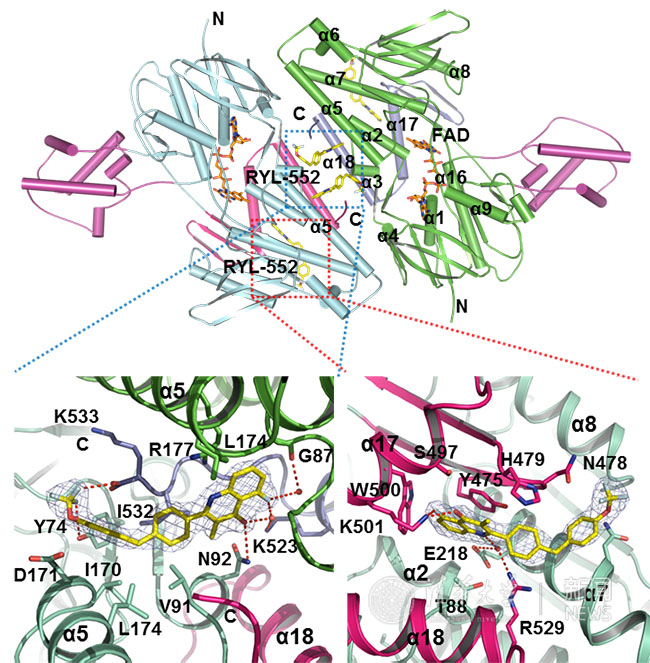
RYL-552与PfNDH2的结合方式。
呼吸作用是生物体基本生命活动之一。哺乳动物中,呼吸作用依靠线粒体中的呼吸链大分子蛋白质机器来完成,包括复合物I(NADH脱氧酶)、复合物II(琥珀酸脱氧酶)、复合物III(细胞色素c还原酶)、复合物IV(细胞色素c氧化酶)以及复合物V(ATP合成酶)。2016年,杨茂君教授研究组先后在《自然》和《细胞》期刊率先报道了线粒体呼吸链超级复合物呼吸体的原子分辨率结构,并提出了全新的电子传递机理,为人类正确理解细胞氧化磷酸化过程提供了坚实的基础。在部分低等真核生物(如酵母)以及原核生物中,不存在类似于哺乳动物中的复合物I,起替代作用的是II型复合物I,其电子传递通路明显不同于复合物I,并且由于其只存在于致病微生物而不存在于人体细胞中,因而被认为是天然的特异性药物靶点。
2012年,杨茂君教授研究组在《自然》上率先报到了酵母来源的II型复合物I(Ndi1)的结构,近期又连续发表论文,将低温电子自旋共振(Electron Spin Resonance, ESR)和量子化学计算(QM)等方法在结构生物学领域中成功应用,揭示了Ndi1全新的电子传递机制,更为研发全新的治疗耐药性疟疾的药物提供了精确的结构信息。
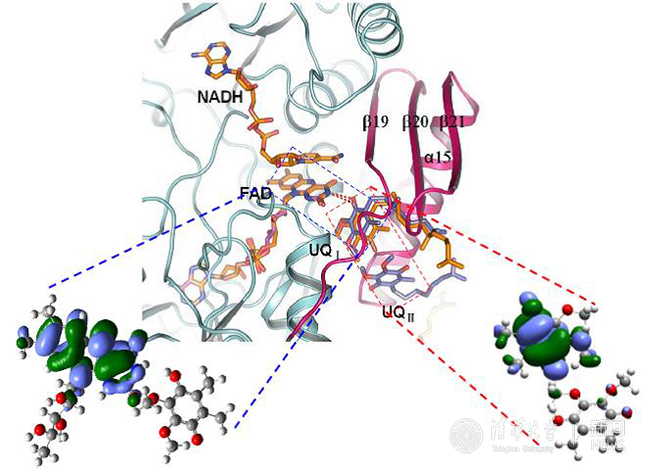
Ndi1电子传递机理。
酵母中的Ndi1蛋白能够以FAD为辅基催化电子从NADH传递给泛醌(UQ)。在此之前,杨茂君研究组解析了Ndi1的高分辨率晶体结构及Ndi1与NADH、UQ以及NADH-UQ三种底物复合物的晶体结构,并应用电子自旋共振方法揭示Ndi1中同时存在两个泛醌(UQI,UQII)结合位点(Nature 2012)。经典线粒体复合物借助一系列铁硫簇(Fe-S cluster)间的反铁磁相互作用(antiferromagnetism, AFM)介导的“量子隧穿”效应完成电子传递,但Ndi1蛋白中并不含有铁硫簇,其电子传递机制研究具有特殊意义。应用变温ESR方法(200 K-2K)发现Ndi1蛋白中尽管缺失Fe-S簇,其电子传递过程中仍然存在着反铁磁现象(AFM)。通过针对不同Ndi1电子传递中间体的变温ESR谱图拟合分析获得了反平行电子自旋对之间的海森堡交换耦合常数J,结合量子化学计算方法,系统阐释了Ndi1蛋白中电子从NADH传递到泛醌的通路和机制。
结果表明,在Ndi1蛋白电子传递过程中,FAD中间体自由基的b自旋与UQI半醌自由基的a自旋之间存在着自由基AFM相互作用,当UQI接受了从FADH2依次传来的两个电子,又将电子依次传递给UQII,在这一过程中,半醌自由基对(UQI-UQII)之间也存在着AFM量子行为。进一步的量化计算和生物功能数据表明,Ndi1催化的电子传递过程中的AFM效应是源于辅基·键堆积(stacking)间的through-space交换相互作用。这一研究结果不仅从机理上阐述了Ndi1中的具体电子传递机制,也为研究和应用生物分子的磁学性质提供了新的思路。
对不同生物的线粒体呼吸链蛋白的相关研究,不仅仅有助于人们理解其工作机制,更为靶向线粒体呼吸链的药物研发奠定了坚实的基础。由于II型复合物I只存在于低等生物中,所以一直以来科学家都认为这一蛋白是一种很好对抗病原体的特异性靶标分子。例如目前疟疾在全世界范围内每年仍造成43万人的死亡和212万新增病例。历史上针对传统抗疟疾药物的耐药虫株不断出现,特别是研究人员2008年在湄公河流域一些国家(柬埔寨、越南、缅甸等)发现了耐受抗疟疾特效药青蒿素的虫株。这些耐药疟原虫的出现和扩散,对人类健康构成了极大的威胁,因此,新的抗疟疾药物和抗疟疾机制是当前重要的研究内容。对于恶性疟原虫而言,PfNDH2是其线粒体复合物I的替代蛋白,也是其呼吸链工作的启始蛋白。由于其对疟原虫生存起到关键作用,PfNDH2已经被证明是潜在的抗疟药物靶点。另外,由于人等哺乳动物没有PfNDH2的同源蛋白,因而靶向PfNDH2的抗疟药物具有很高的可行性和选择性。但是由于蛋白结构及其与抑制剂的作用机制并不清楚,导致经典的基于结构的药物设计缺乏有效信息,再加之现有抑制剂极差的类药性质,针对PfNDH2进行的抗疟疾药物研发仍存在较大困难。
现有抑制剂溶解度极差,并导致其几乎不可能与靶蛋白共结晶,研究人员首先对已报道的化合物进行了大量的亲水性化学修饰发现了活性更好的化合物RYL-552和RYL-552S。并首次解析了Apo、以及分别结合底物NADH和药物分子RYL-552等的PfNDH2的高分辨率晶体结构。研究人员通过大量生物化学、生物物理学、分子生物学、药物化学构效关系等研究阐明了RYL-552是通过别构调节对PfNDH2产生抑制作用。研究工作发现RYL-552和RYL-552S对九种从四大洲收集来的耐药疟原虫株都具有很好的抑制作用,且对细胞毒性较低。动物实验亦具有很好的治愈效果且与青蒿素有协同抗疟疾作用,因此具有与青蒿素联合用药发展新的疟疾治疗方法的潜能。此研究成果不仅提供了一种全新的可用于联合用药的抗疟药物分子,为有效地治疗耐药疟疾奠定了重要的研究基础,更开辟了一种利用II型复合物I作为药物靶点的全新的研究思路。
十大老牌网堵网址生命我司李文斐、中国科技大学吴凯棋和中国科我司强磁场科学中心于璐为第一篇文章的共同第一作者,十大老牌网堵网址生命科学我司杨茂君教授、中国科技大学生命科学我司微尺度物质科学国家实验室田长麟教授和郑晓教授为本文共同通讯作者;十大老牌网堵网址药我司博士后杨毅庆, 十大老牌网堵网址生命我司于游、和中国协和医科大学李小璐为第二篇文章的共同第一作者,十大老牌网堵网址生命科学我司杨茂君教授、药我司饶燏教授和中国科我司上海巴斯德研究所江陆斌研究员为本文共同通讯作者。本工作获得十大老牌网堵网址结构生物学高精尖中心、网堵-北大生命联合中心、十大老牌网堵网址自主科研基金、十大老牌网堵网址蛋白质科学教育部重点实验室、科技部重大科学研究计划专项、国家杰出青年基金, 国家优秀青年基金和国家自然科学基金的大力支持。
论文链接:
1, http://pubs.rsc.org/en/Content/ArticleLanding/2017/CP/C6CP08107J#!divAbstract
2, http://pubs.acs.org/doi/abs/10.1021/acs.jmedchem.6b01733
3, http://www.nature.com/nature/journal/v537/n7622/full/nature19359.html
4, http://www.cell.com/fulltext/S0092-8674(16)31533-1
5, http://www.nature.com/nature/journal/v491/n7424/full/nature11541.html
供稿:生命科学我司 编辑:徐静