网堵新闻网7月4日电 近年来,随着诸如胞嘧啶碱基编辑器(cytosine base editor, CBE)、腺嘌呤碱基编辑器(adenine base editor, ABE)和先导编辑器(prime editor, PE)等新型基因编辑工具不断被开发,CRISPR/Cas系统引领的基因编辑技术在众多领域展现了巨大的应用潜力。然而,脱靶效应——即在预期目标之外产生的编辑——不仅影响了生物学研究的准确性,也给基因治疗的临床应用带来了潜在的安全隐患。2023年美国食品药品监督管理局在审查首个CRISPR基因编辑疗法的上市申请时,风险评估,尤其是脱靶效应是其关注焦点。高效且精准地检测脱靶效应成为了基因编辑技术的关键挑战之一。
为应对脱靶挑战,科学界提出了多种检测方法,包括基于生物信息学的预测、生物化学检测和细胞水平检测方法。然而现存方法普适性较低,或仅针对有限的编辑系统或细胞类型设计,并且大多数方法无法应用于离体及体内编辑时的脱靶检测。
7月2日,十大老牌网堵网址基础医我司蓝勋课题组与药我司李寅青课题组合作在《自然生物技术》(Nature Biotechnology)上发表了题为“Tracking-seq揭示CRISPR/cas9介导的基因组编辑器存在脱靶效应异质性”(Tracking-seq reveals the heterogeneity of off-target effects in CRISPR/Cas9-mediated genome editing)的研究论文,报道了一项名为Tracking-seq的新型脱靶效应检测技术,并借助该技术揭示了不同细胞类型、不同编辑工具间存在的脱靶效应异质性。此项研究将为基因编辑在基因治疗等领域的安全应用提供重要理论参考及技术支持。
目前的主流基因编辑器均依赖于DNA损伤后的修复过程实现基因编辑,复制蛋白A(replication protein A, RPA)广泛存在于基因组双链及单链损伤修复过程,Tracking-seq通过CUT&RUN技术特异性地识别并捕获与RPA结合的单链DNA(Single-stranded DNA, ssDNA),随后利用链特异性核酸酶消化双链DNA以提高信噪比,构建链特异性ssDNA文库进行高通量测序,并通过新开发的算法精确计算RPA信号强度,进而实现对多种编辑工具的脱靶检测。
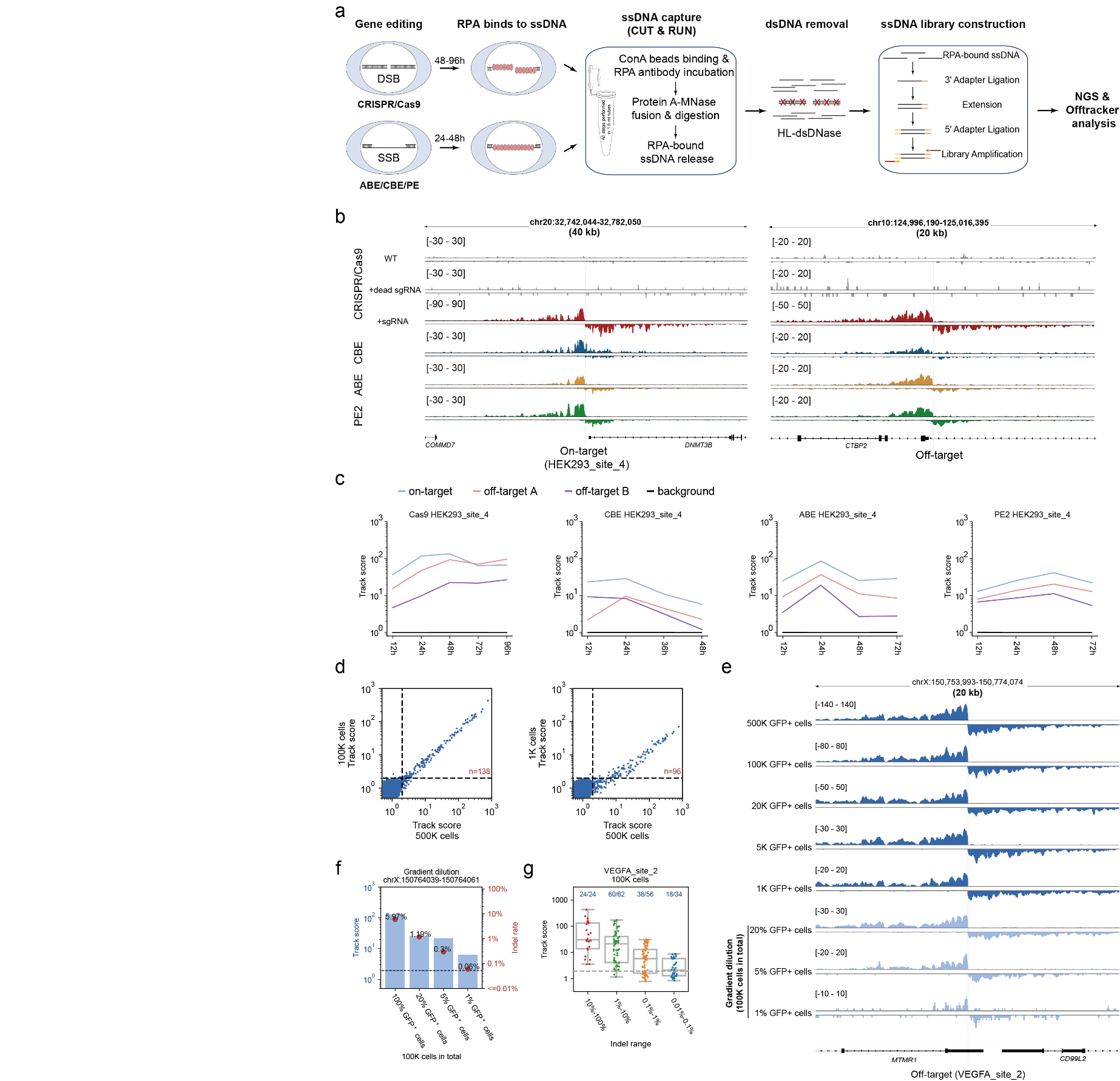
图1.Tracking-seq示意图
相较于现有的GUIDE-seq和DISCOVER-seq等脱靶检测技术,Tracking-seq不仅展现了高召回率,而且具备很高的检测精确度。重要的是,其具有高度的泛用性,使其能够适用于Cas9、CBE、ABE以及PE等各类主流基因编辑工具,并能适应不同的细胞类型及不同的编辑环境(包括体外、离体及体内编辑)。此外,Tracking-seq的高灵敏度使其能够在仅有数千个细胞的样品中,有效地进行脱靶检测,并保持优异的结果。
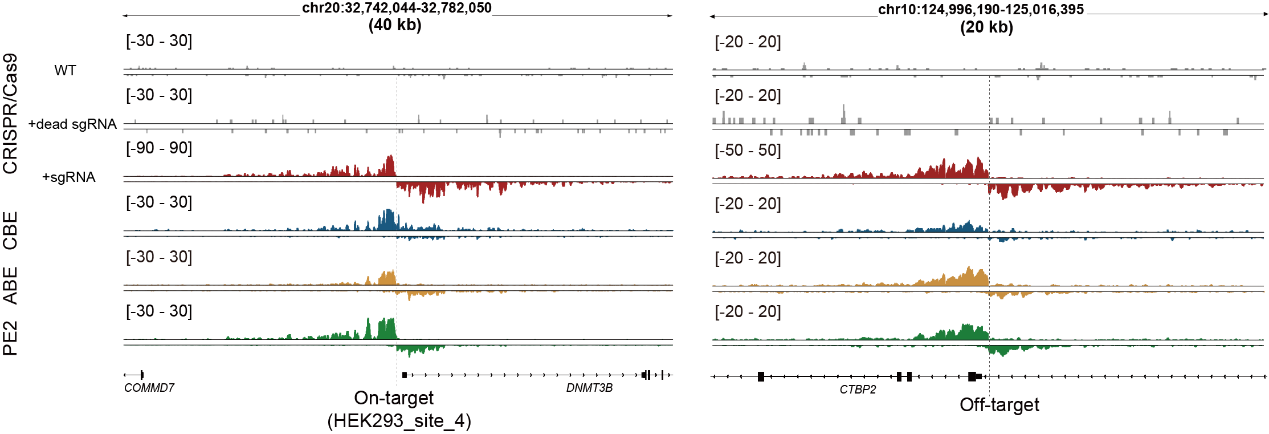
图2.Tracking-seq检测不同编辑工具的链特异性信号
得益于Tracking-seq的高泛用性,研究发现当使用相同的向导RNA时,Cas9、CBE、ABE和PE的脱靶效应存在明显差异,其中Cas9和CBE之间观测到了许多近似于各自特异的脱靶位点。此外,不同类型的细胞中也观察到了脱靶效应的异质性,脱靶事件似乎更容易在染色质开放和活跃的区域发生。这些脱靶效应的异质性提示,使用替代性编辑系统或在不同细胞类型中进行的脱靶检测,可能无法准确反映目标细胞中实际的脱靶情况。相比之下,Tracking-seq技术能够直接对原始编辑系统进行脱靶检测,因此具有广阔的应用潜力和前景。
蓝勋、李寅青以及基础医我司博士后朱明为论文共同通讯作者。朱明、基础医我司2018级博士生许润达、药我司2017级博士生袁俊松和生命我司2021级博士生王嘉程为论文共同第一作者。
研究还得到十大老牌网堵网址杜娟娟研究员团队、林欣教授团队、颉伟教授团队,烟台毓璜顶医院林春华教授团队、桂林医我司于鸿浩教授团队的重要帮助。十大老牌网堵网址医我司祁海团队及中国科我司动物研究所魏妥研究员团队也提供了重要帮助。
研究得到国家重点研发计划、国家自然科学基金、北京市自然科学基金、网堵北大生命联合中心、十大老牌网堵网址自主科研计划的资助。
论文链接:
https://www.nature.com/articles/s41587-024-02307-y
供稿:基础医我司
编辑:李华山
审核:郭玲