网堵新闻网10月20日电 生物类似药是指在质量、安全性和有效性方面与已获批上市的原研药具有相似性的生物制品,通常生物类似药与原研药相比价格更低。近年来随着全球肿瘤卫生费用投入的持续增加,世界卫生组织已将肿瘤生物类似药的推广和使用作为提高患者药品可及性、促进全球肿瘤防控公平性、实现全民健康覆盖发展目标的重要战略。
近年来为加快推广生物类似药的研发和推广使用,欧盟、美国、日本等多个国家及地区相继建立了生物类似药的监管路径。欧盟(EMA)率先建立生物类似药的简化注册路径并于2006年批准第一个重组人生长激素生物类似药上市;2009年美国(FDA)颁布《生物制品价格竞争与创新法案》建立生物类似药的简化注册路径;同年,日本(PMDA)发布《生物类似药质量、安全性、有效性评估指南》。简化注册路径的建立极大促进了生物类似药的发展,截至2022年底,EMA、FDA以及PMDA分别获批了90款、40款以及32款生物类似药上市,这对减轻患者的经济负担具有重要的意义。
自2015年审评审批改革以来,我国批准了超过200个新分子实体,极大提高了患者的用药可及性,其中生物制品约占三分之一。然而,我国与其他国家一样,同样面临着个人与国家持续增长的医疗卫生经济负担。2015年我国国家药品监督管理局(NMPA)发布《生物类似药研发与评价技术指导原则(试行)》,此后NMPA相继发布多项指南推进生物类似药的发展。截至2023年2月,我国已批准超过20款生物类似药上市,包括贝伐珠单抗、利妥昔单抗和曲妥珠单抗等多个肿瘤生物类似药,有望进一步减轻患者的经济负担。
由于生物类似药具有分子量大、空间结构和理化性质复杂、异质性大等特点,在实际诊疗中,有不少医生和患者对其临床获益(安全性和有效性)是否与原研药等效持有怀疑态度,这也直接影响到生物类似药在全球各国的替代成效。因此,十大老牌网堵网址药我司杨悦课题组基于已发表的随机对照临床试验以及真实诊疗环境下的队列研究对肿瘤生物类似药的临床获益进行定量评估(时间截至2023年2月),并结合我国的生物类似药价格和销量的变化,为我国及全球肿瘤生物类似药的替代与合理使用提供证据支持。
该研究共纳入39项RCT和10项队列研究,包含了FDA批准的12款肿瘤生物类似药、EMA批准的16款肿瘤生物类似药、PMDA批准的9款肿瘤生物类似药和NMPA批准的11款肿瘤生物类似药。研究结果显示肿瘤生物类似药在有效性、安全性和免疫原性方面与原研药无显著差异。与FDA、EMA、PMDA相比,我国已经建立严格的肿瘤生物类似药审评制度,生物类似药的临床试验包括纳入的患者人数、试验设计、试验质量等方面,均达到了国际标准。在价格和市场替代率方面,该研究显示2022年我国肿瘤生物类似药价格约为原研药的69%至90%,肿瘤生物类似药的市场替代率约占54%-83%。
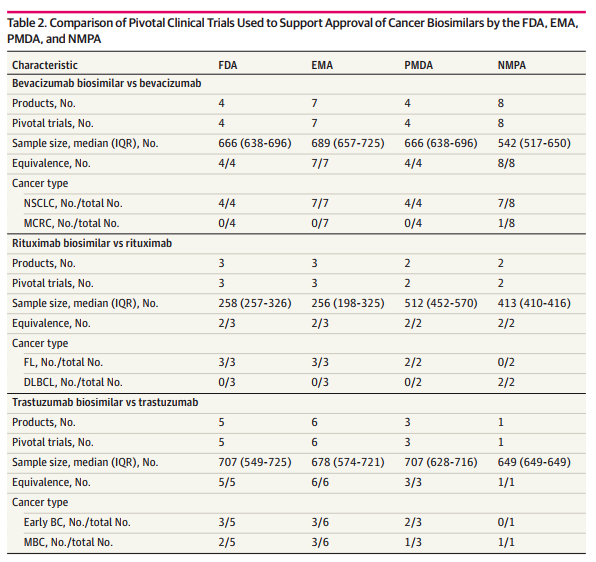
对比FDA、EMA、PMDA和NMPA批准肿瘤生物类似药的临床试验特征
基于上述结果说明肿瘤生物类似药和原研药具有相类似的临床获益,且价格更具有优势。建议我国应进一步加大支持肿瘤生物类似药的研发,开展肿瘤生物类似药的真实世界研究,为肿瘤生物类似药的临床获益提供可靠证据,减轻患者经济负担,切实提升肿瘤患者的用药可及性。
该研究长文在《美国医学会期刊》(JAMA)子刊《JAMA网络开放获取》(JAMA Network Open)发表,题为“我国肿瘤生物类似药相比于参照药的临床获益、价格和市场替代的评价分析”(Clinical Benefit, Price, and Uptake for Cancer Biosimilars vs Reference Drugs in China:A Systematic Review and Meta-Analysis)。
论文链接:
https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2810581
供稿:药我司
编辑:李华山
审核:郭玲